

Investigadores descubrieron que una proteína de la bacteria de la brucelosis mejora la eficacia de un tratamiento contra el melanoma.
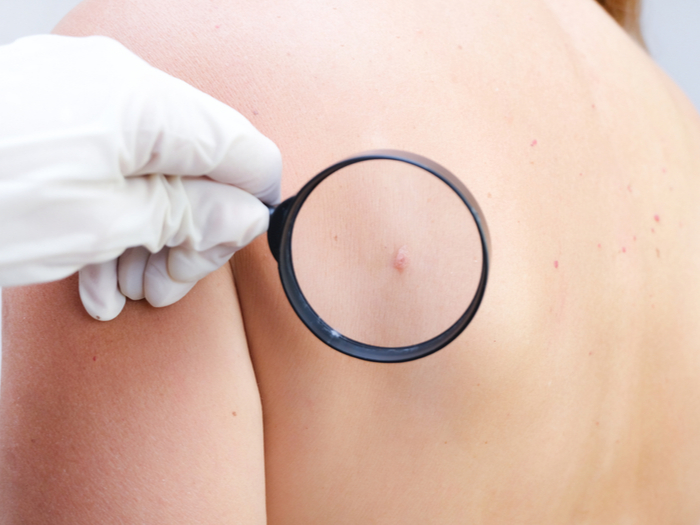
De acuerdo con los resultados de ensayos preclínicos llevados adelante por investigadores de la Fundación Instituto Leloir (FIL), una proteína de la bacteria de la brucelosis mejora la eficacia de un tratamiento contra el melanoma.
Por otra parte, los panelistas revisaron los últimos avances en las pruebas clínicas para el melanoma, las implicancias de la terapia dirigida y las estrategias para la selección de pacientes. Esto fue durante una sesión sobre pruebas genéticas y moleculares, en la última Anual de la Academia Estadounidense de Dermatología (AAD).
La proteína recibe el nombre de lumazina sintasa (BLS). Los investigadores de la FIL la eligieron porque previamente habían descubierto que tenían la capacidad de activar células del sistema inmune. Estas tienen un rol fundamental no solo para combatir infecciones sino también tumores.
A partir de este hallazgo, descrito en la revista PloS One, pensaron que podría aumentar la potencia de las inmunoterapias contra el melanoma. En la actualidad, se administran “inhibidores de punto de control inmunológicos” contra distintos tipos de cáncer, denominados anti-PD-1 o anti-PD-L1. Este tipo de tratamientos levanta “frenos internos” del sistema inmune para destruir células tumorales.
La inmunoterapia con anti-PD-1 o anti-PD-L1 no genera muy buenos resultados contra el melanoma. Sin embargo, se encontró probando una herramienta que podría mejorar su desempeño.
Por ingeniería genética, la proteína BLS puede obtenerse en grandes cantidades a partir de otra bacteria llamada Escherichia coli .
“En el laboratorio estudiamos exhaustivamente las características de BLS y observamos que, además de ser una proteína muy estable y de fácil obtención, despierta una respuesta inmunológica potente y duradera”, subrayó a la agencia de noticias del Instituto Leloir Paula Berguer, una de las investigadoras.
“Descubrimos que gran parte de la respuesta que BLS genera es gracias a su capacidad de unirse a una proteína en la membrana exterior de células de la inmunidad innata, el receptor de tipo Toll 4 (TLR4)”.
Los autores del estudio, publicados en Scientific Reports, comprobaron que, en ratones con melanoma, BLS tuvo un efecto antitumoral. Este aumentó de manera sinérgica por el uso conjunto con la inmunoterapia anti-PD-1. Mediante esta combinación se disminuirá la velocidad de crecimiento del tumor. Además, se aumentará significativamente la sobrevida de los roedores.
Los investigadores notaron que la administración de BLS en los animales portadores de melanoma hizo que, en las zonas cercanas al tumor, disminuyera la proporción de células regulatorias. También, que normalmente frenan la respuesta inmune y que aumenten las células capaces de montar una respuesta que ayude a eliminar las células tumorales.
Además, el tratamiento con BLS indujo un aumento en la cantidad de ciertas células inmunes denominadas “natural killers” (NK) y del interferón gamma (IFN-g). Estas contribuyeron a generar una respuesta antitumoral adecuada en los estudios preclínicos.
De esta manera, los resultados obtenidos en el trabajo sugieren que la administración de BLS incrementa la susceptibilidad del tumor al tratamiento con pruebas anti-PD-1.
En el futuro se realizarán estudios adicionales que permitirán sentarse las bases para la realización de ensayos clínicos en humanos que comprobarán la seguridad y eficacia de esta proteína.
Varios panelistas que participaron en la Reunión Anual de la Academia Estadounidense de Dermatología (AAD) reflexionaron sobre los últimos avances en las pruebas clínicas para el melanoma. Desde la perspectiva de los expertos, las pruebas genéticas y moleculares pueden conducir a una detección más temprana del melanoma. Además de otros tipos de cáncer.
Asimismo, pueden guiar la toma de decisiones sobre el uso de inmunoterapias y terapias dirigidas.
Actualmente hay varias pruebas moleculares disponibles para el melanoma. Por ejemplo, las hibridaciones in situ con fluorescencia (FISH) suelen ser las más conocidas y utilizadas. Junto con la hibridación genómica comparativa (CGH), el perfil de expresión génica y la secuenciación de próxima generación (NGS).
FISH y las pruebas de expresión génica como MyPath funcionan bien en casos inequívocos de melanoma. Pero la especificidad y la sensibilidad de estos ensayos decrecen cuando se encargan de evaluar casos desafiantes de tumores ambiguos. Particularmente para las regiones spitzoides.
Se demostró que la evaluación de CGH del genoma completo es ventajosa. Pero su incapacidad para determinar partes individuales de un tumor hace que la prueba sea menos efectiva para determinar células específicas.
En tanto, el método NGS examina todas las consecuencias accionables. Este enfoque permite tanto la evaluación del genoma completo como de las células individuales. Pero puede ser una técnica onerosa debido a la cantidad de datos que puede generar
Decidir qué pacientes se beneficiarían de las pruebas genéticas es otro tema a considerar para los dermatólogos. Existen varios factores de riesgo relacionados con el melanoma. En particular, la herencia de un gen autosómico dominante por ser miembro de una familia con antecedentes de melanoma.
Estos pacientes tienen el riesgo relativo más alto de melanoma, que oscila entre el 35% y el 70%. Además de correr el riesgo de padecer otros tumores, como cáncer de páncreas. Por lo tanto, constituyen una población susceptible de ser examinada mediante pruebas genéticas.
En la disertación los investigadores indicaron que utilizar la «regla de 3» como criterio de selección para la evaluación genética de pacientes con melanoma familiar. En esta, solo se debe cumplir un criterio de los siguientes, siempre que sea mayor o igual a 3 melanomas:
Al tener en cuenta el surgimiento de las pruebas de panel, la «regla de 3» se amplió aún más para examinar la incidencia de otros cánceres. Por ejemplo, el de colon, mama y ovario. Fue para decidir si seguir adelante con las pruebas genéticas en pacientes con melanoma hereditario.
Por otra parte, se sospecha que el medio ambiente, la radiación ultravioleta y la geografía que provoca la exposición a ese entorno supone riesgos adicionales. También lo hace el grado invasivo del melanoma y la edad del paciente.
fuentes:
Fundación Instituto Leloir
Revista estadounidense de atención administrada (AJMC)
Pediatría
250 horasMedicina general
100 horasSuscripción exitosa
¡Muchas gracias por suscribirte
a nuestro newsletter!